Периодической системе элементов исполнилось 150 лет
Это лишь маленькое преувеличение заявить, что любые ультрасовременные открытия стоят в паре шагов от периодической таблицы элементов. Великое приключение по её созданию начиналось с "коллекционирования" химических элементов. По мере их накопления ученые всё сильнее хотели коллекцию систематизировать. Гений Менделеева позволил сложить величайший химический пасьянс в истории. Но на этом приключение не закончилось. Возможно, только сейчас пришло время прекратить расширять коллекцию, так как практическое значение такой научной работы почти исчезло.
“La république n’a pas besoin de savants ni de chimistes”, или «Республике не нужны ученые и химики», - ёмко поведал революционный трибунал и предложил Антуа́ну Лора́ну Лавуазье́ пройти на гильотину, которая подвела итог короткой жизни французского основателя современной химии. Некоторые считают его величайшим химиком всех времён, пишет The Economist.
У Лавуазье был один грешок - он работал сборщиком налогов. В 1768 году он вступил в корпорацию «Ferme générale», или «Генеральный откуп», - компанию финансистов, которая в 1726 году получила по договору право сбора королевских податей и других косвенных налогов на откуп (в аренду). Сперва он был пайщиком у откупщика г-на Бодона. Со смертью последнего в 1779 году Лавуазье стал самостоятельным и состоятельным членом откупа.
Откупная система, когда финансист ездил по стране, собирал подати и отщипывал себе «небольшую часть» собранного в качестве вознаграждения (до 40% всех сборов), была не очень любима. Поэтому тот факт, что трибунал 19 флореаля II года (8 мая 1794 года) приговорил всех откупщиков Франции, или 31 человека, к смерти, не является неожиданностью.
Но Лавуазье несколько отличался от своих коллег по откупу тем, куда он вкладывал свои доходы. Большая часть средств уходила на содержание и развитие лучшей химической лаборатории в Европе. Уже в те времена фундаментальная наука не была дешёвым удовольствием.
Ничто не появляется из ниоткуда. До сих пор спорят, в какой лаборатории появились ростки будущей периодической системы элементов. Лаборатория Лавуазье представляется не худшим местом, чтобы история началась оттуда, ведь французский химик первым опубликовал исчерпывающий (по тем временам) перечень химических элементов — веществ, не способных разрушиться в результате химических реакций с другими веществами.
Именно Лавуазье и его жена Мари-Анна впервые внедрили методику количественного измерения того, что вошло в химическую реакцию и что вышло из неё. Это стало способом постижения сути химических преобразований. Список Лавуазье, опубликованный в 1789 году, то есть за пять лет до его казни, состоял всего из 33 химических элементов. Из них 23, или пятая часть от современной периодической системы элементов, выдержали проверку временем.
Некоторые элементы - золото, железо и сера - были известны с древних времен. Другие - марганец, молибден и вольфрам - были открыты позже. Но в списке не было структуры. Это была Avant La Lettre - «коллекция марок» без чёткой классификации.
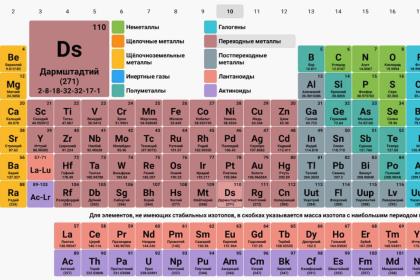
На классификацию, или на понимание того, как должна выглядеть окончательная структура, ушло полтора столетия. Зато теперь периодическая система элементов - привычная деталь любого школьного класса химии. Её простые строки и столбцы состоят из прямоугольников, каждый из которых содержит аббревиатуру имени элемента вместе с его последовательным атомным номером. Она представляют собой чёткий порядок нашей вселенной, который поразил бы Лавуазье. Не будет большим преувеличением сказать, что почти все в самой ультрасовременной науке стоит в удалении всего на один или два шага от этой периодической таблицы Менделеева.
Могучий атом
Тщательные измерения Лавуазье привели к повторному открытию того, что теперь считается привычным - к закону сохранения массы (первым был русский учёный Михаил Ломоносов). Согласно ему, масса [физической] системы сохраняется при всех природных и искусственных процессах. То есть химия преобразует природу веществ, но не их общую массу.
Другой француз - Жозеф Луи Пруст - продолжил идею Лавуазье, предложив закон постоянства состава. Этот закон, впервые опубликованный в 1794 г., в год казни Антуана Лавуазье, гласит: любое определенное [химически чистое] соединение, независимо от способа его получения, состоит из одних и тех же химических элементов, причём отношения их масс постоянны (а относительные числа их атомов выражаются целыми числами). Теперь это один из основных законов химии, который справедлив только для веществ с молекулярным строением.
Прусту оставался небольшой шаг до химического атомизма, но он его не сделал - он не принял идею, что соединения состоят из частиц различных (атомных) весов, а каждый вес представляет собой конкретный элемент. Это понимание пришло другому учёному - англичанину Джону Дальтону - человеку, который был полярной противоположностью аристократическому бонвивану Лавуазье. Родители Дальтона были настолько бедны, что он начал работать в возрасте десяти лет. До конца своей жизни Дальтон оставался аскетичным квакером, который не различает цвета.
Дальтон жил в Манчестере, в то время крупнейшем промышленном городе в мире. Он поддерживал скромную жизнь репетиторством, но тратил большую часть своей энергии на научные исследования, включая изучение цветовой слепоты, которую теперь называют в честь него дальтонизмом. В начале XIX века он взял концепцию Пруста и показал, что химические элементы не только реагировали в фиксированных пропорциях по массе, но что эти пропорции были соотношением малых целых чисел.
Самым простым способом объяснить открытие - и Дальтон загорелся этой идеей - это предположить, что каждый химический элемент состоит из крошечных, неделимых частиц, которые имеют одинаковый вес. Греческим словом для неделимого является "atomos". Таким образом родился атом.
Дальтон основал свою систему относительных атомных весов на водороде, атомы которого, как он обнаружил, являются самыми легкими. И его идею подхватил другой учёный, который теперь менее известен, чем Лавуазье, но который, возможно, даже более велик.
Швед Йёнс Якоб Берцелиус оснастил химию её современным языком. Именно он придумал идею аббревиатур, которые теперь занимают прямоугольники периодической таблицы. Именно он объединил эти сокращения с цифрами, указывая на пропорции, чтобы описать формулу для химических соединений: H2O (вода), H2SO4 (серная кислота), NaCl (столовая соль). И именно он использовал эти формулы для описания реакций: H2SO4 + Zn → ZnSO4 + H2 (серная кислота плюс цинк становятся сульфатом цинка плюс водород). Хотя Дальтон изобрел теорию атомизма, но Берцелиус сделал её душой и сердцем химии.
И Берцелиус сделал даже больше. Он использовал недавно изобретенную батарею Алессандро Вольта, которая создавала электричество из химической реакции, чтобы сделать ровно обратное. Он использовал электричество для запуска химических реакций в растворах (например, получая медь из раствора сульфата меди). Он придумал процесс под названием электролиз.
Вернёмся в Англию, где сэр Гемфри Дэви, изобретатель первой шахтёрской масляной безопасной лампы, взял идею электролиза и мощно её подзарядил. Он взял самую мощную версию аккумулятора Вольта для расщепления расплавленных материалов, а не растворов. Таким образом он обнаружил натрий и калий в 1807 и магний, кальций, стронций, барий и бор в 1808 г. Он также показал, что хлор, ранее считавшийся соединением кислорода, на самом деле является элементом.
После работы Дэви новые элементы стали расти как грибы. Йод (1811), кадмий и селен (1817), литий (1821), кремний (1823), алюминий и бром (1825). К тому времени их оказалось достаточно, чтобы сделать следующий шаг на пути к современной периодической системе элементов
Уже со времени открытия этих элементов стало очевидно, что натрий и калий похожи, как и кальций, стронций и барий. Литий, при обнаружении, оказался похож на натрий и калий. Аналогичным образом бром и йод оказались схожими с хлором. В 1829 г. немец Иоганн Вольфганг Дёберейнер обнаружил любопытную особенность этих «трио» (члены групп теперь называются щелочными и щелочноземельными металлами и галогенами), а также еще одного трио с аналогичными свойствами, куда входят сера, селен и теллур. В каждом случае, если членов трио выстроить в порядке их атомных весов, то средний элемент (натрий, стронций, бром и селен) всегда имел вес, который был средней величиной от суммы самого легкого и самого тяжелого в каждом из трио. Дёберейнер назвал это законом триад. Это был первый намек на некую системную картину, который сперва остался малозаметным.
«Коллекция марок» продолжала расти: торий (1829), лантан (1838), эрбий (1843) и рутений (1844). Затем в 1859 г. немецкие друзья Роберт Вильгельм Бунзен и Густав Роберт Кирхгоф показали, что новые элементы могут быть распознаны с помощью спектрального анализа пламени, то есть из ярко окрашенных линий - спектров, полученных при нагреве материалов с помощью горелки Бунзена. Подход дал мгновенный успех, и немцы добавили в список цезий (1860) и рубидий (1861). Другие с помощью их метода обнаружили таллий (1861) и индий (1863). Величайшим триумфом спектрального анализа стало открытие гелия (1868), который в отличие от других элементов был найден не с использованием горелки Бунзена, а анализом солнечного спектра.
По мере обнаружения новых элементов поиск порядка или системы интенсифицировался. В 1864 г. британец Джон Ньюлендс, которому мать итальянка с детства привила любовь к музыке, почти нашёл его. Он опубликовал таблицу, которую назвал «законом октав». Упорядочив известные элементы в порядке их атомного веса, он полагал, что разглядел подобно восьмой ноте октавы в музыке, как каждый восьмой химический элемент циклически «рифмуется», что натрий рифмуется с калием, а хлор с бромом.
Беда схемы Ньюлендса была в том, что появлялось слишком много надуманных «рифм». Взгляд на современную периодическую таблицу показывает почему. Для высоких, внешних колонок (и водорода, который является «законом в себе») октавы британца работают идеально для легких элементов. Однако с четвёртой строки, начинающейся с калия (K), высокие внешние колонки отделяются друг от друга «вторжением» десяти других более коротких колонок, известных сейчас как переходные металлы. Чтобы справиться с этим вторжением с помощью доступных на тот момент данных, требовалась смесь удачи и гения. И эта смесь проявится через несколько лет после публикации Ньюлендса. Счастливый гений уже мучился над этим вопросом в Санкт-Петербурге.
Менделеев
Альберт Эйнштейн, по молодости выглядевший заурядно, стал культивировать образ «странного учёного» в пожилом возрасте, что способствовало позднее появлению в культуре образа «безумного профессора». Дмитрий Менделеев (на фото ниже) выглядел так с самого начала — ему раз в год стриг волосы пастух, который использовал ножницы для стрижки овец.

Он даже вёл себя как безумный профессор. В приступах ярости он был склонен к танцам. Один биограф как-то сравнил его с главным героем одной из сказок братьев Гримм, с Румпельштильцхеном. Но как и злобный сказочный карлик Менделеев, метафорически, умел плести из соломы золото.
Менделеев учился у Бунзена в Германии и даже проработал вместе с немецким ученым и его другом Кирхгофом некоторое время, но затем вернулся на родину. В 1869 году он был профессором общей химии в Петербургском университете и писал учебник по химии на русском языке. 14 февраля по юлианскому календарю, принятому тогда в России, или 26 февраля по григорианскому календарю, используемому в остальных странах Европы, он работал с галогенами и щелочными металлами, ломая голову над общим организационным принципом, который мог бы стать шаблоном для периодизации. 14 февраля было пятницей, и проблема захватывала его всё больше и больше в наступившие выходные. Но в понедельник 17-го, ожидая сани, чтобы отправиться на вокзал для поездки в свой загородный особняк, его настигло озарение.
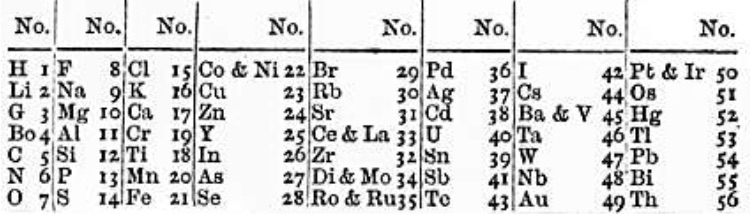
Менделеев был заядлым любителем карточных пасьянсов. Его озарение подсказало ему, что как игральные карты могут быть упорядочены в группы по мастям, где ранжируются в соответствии с их номиналом, так и химические элементы могут быть собраны в группы с одинаковыми химическими и физическими свойствами элементов, где выстраиваются в зависимости от их атомного веса.
Раскладывая в уме набор из 63 игральных карт, каждая из которых соответствовала одному известному на том момент химическому элементу, Менделеев смог собрать, пожалуй, самый важный пасьянс в истории человечества.
Впоследствии он утверждал, что ответ пришел к нему во сне. Возможно, ведь после того, как человек работает в течение четырех дней почти без отдыха, граница между сном и бодрствованием довольно размыта. Какими бы ни были детали, результатом стала сетка из «карт», которая организовывала элементы в определенном порядке (см. рисунок). Он опубликовал её через две недели.

Эта сетка не была идеальна, и в ней зияли пустоты. Но именно эти пустоты продемонстрировали гений Менделеева. В то время никто не сомневался, что открыты не все элементы, но другие ученые, включая Ньюлендса, вели себя так, как будто они были открыты. Менделееву хватило научной наглости оставить пустоты для будущих элементов. Тогда это посчитали слабостью его новой периодической таблицы элементов.
Но это оказалось самой сильной частью его озарения. Он описал химические и физические свойства элементов, которые предстоит открыть. И открытия последовали. И в целом все предсказания великого учёного сбылись.
В оригинальной таблице Менделеева были места, где она работала с элементами «шулерства», то есть он разместил некоторые элементы по соседству с теми местами, где они должны были бы стоять согласно их измеренным атомным весам. Менделеев утверждал, что принятые веса были неверными и нуждались в повторном измерении. Большей частью он оказался прав, но не в каждом случае. Несколько таких пар, например, кобальт и никель, которые разделили один слот уже в оригинальной таблице, упорно оставались вне новой системы, предупреждая, что атомный вес в действительности является проявлением более глубокого структурного принципа.
Самое главное, Менделеев оказался не скован красивым шаблоном, как это случилось с Ньюлендсом. Он отказался от жёстких предубеждений, что всё должно быть разложено по полочкам. Там, где октавы британца не работали, или его пасьянс не сходился полностью, Менделеев позволил сетке вырваться из жесткого корсета. Это можно увидеть как в верхней, так и в нижней части опубликованной таблицы.
Верхняя правая часть оригинальной таблицы содержит переходные металлы. Здесь последующие открытия показали, что Менделеева более или менее корректен в своих умозаключениях. Нижняя левая часть оказалась более проблемной. Её содержимое является кучей-малой, которая содержит все известные элементы, называемые лантаноидами. Возможно, Менделееву повезло, что к 1869 г. было обнаружено только три лантаноида. В современной таблице их 15 и вместе с актиноидами, которые смешались в одной клетке ниже лантаноидов, они образуют ту неловкую интерполяцию, которая часто отмечена звёздочкой для перехода к дополнительной подтаблице внизу основной. Есть небольшая интрига или загадка в том, сложился бы великий химический пасьянс Менделеева, если бы больше лантаноидов было изобретено к тому моменту.
В оригинальной таблице Менделеева был также пробел, заполнение которого стало одной из величайших побед в создании современной периодической системы элементов. Гелий, который Менделеев проигнорировал, так как его атомный вес не мог быть установлен в то время, оказался самым легким членом целой новой строки (или колонки в современной таблице). Туда входят благородные газы, необнаруженные ранее, потому что они химически инертны. Кроме гелия туда вошли неон, аргон, криптон, ксенон и радон.
Подобно множеству элементов, открытых одним Гемфри Дэви, благородные газы почти все, кроме радона, появились усилиями британца сэра Уильяма Рамзая. С различными помощниками он выделил аргон в 1894 г., гелий - в 1895 г., неон, криптон и ксенон вместе - в 1898 г. Вместо химии он использовал физические процессы. Все, кроме гелия, были результатом использования учёным появившейся криогенной технологии, которую он приспособил для сжижения воздуха, а затем разделил его на компоненты, воспользовавшись разными температурами кипения. Гелий он обнаружил при нагревании минерала под названием клевеит.
Трансмутация элементов
В 1890-е гг. появились первые намеки на то, что атомы не могут, несмотря на смысл своего имени, быть поистине неделимыми. Первоначальные доказательства того, что атомы могут терять части самих себя, и поэтому должны иметь меньшие компоненты, пришли в 1896 г. Тогда Анри Антуан Беккерель, который исследовал природу фосфоресценции, завернул некоторые соли урана в фотобумагу и обнаружил, что бумага оказалась затуманенной. Таким образом Беккерель обнаружил радиоактивность.
В следующем году сэр Джозеф Джон Томсон выяснил, что «катодные лучи», излучаемые отрицательным электродом, были электрически заряженными частицами, которые весили гораздо меньше, чем любой атом. Затем в 1899 г. Эрнест Резерфорд, бывший студент Томсона, показал, что в излучении Беккереля было два компонента, которые он назвал "альфа" (тяжелые, положительно заряженные частицы) и "бета" (легкие, отрицательно заряженные).
Сам Беккерель доказал в 1900 г., что бета-частицы были аналогичны катодным лучам Томсона. Семь лет спустя Резерфорд обнаружил, что альфа-частицы были ионами гелия. Заодно он объяснил этим, почему клевеит, который является рудой урана, также является источником гелия. Настало время для одних из самых важных экспериментов в истории: Резерфорд пытается выяснить, как выглядят атомы.
Одной из догадок к тому времени была идея, что атомы - это «вихри» в среде под названием эфир, благодаря которому распространяются свет и радио волны. Однако эта гипотеза умерла вместе с самим эфиром, когда существование последнего было опровергнуто экспериментально в 1890-х гг.
Эксперименты Резерфорда, проведенные между 1908 и 1910 гг., исследовали вопрос через стрельбу альфа-частицами по золотой фольге. Большинство свободно проходили через неё, что было зафиксировано мерцанием экрана за фольгой (сцинтиллятора). Но несколько частиц отклонялись от курса, что было зафиксировано другими экранами, один из которых стоял позади источника альфа-частиц. Этот феномен возврата Резерфорд объяснил так: «Почти так же невероятно, как если бы вы выстрелили из 15-дюймовой пушки по листу бумаги, а снаряд бы отскочил от него и ударил по вам". Феномен позже получил полное научное подтверждение: атомы в фольге имели положительно заряженные ядра, которые отражали положительно заряженные альфа-частицы, но эти ядра атома были окружены отрицательно заряженными электронами.
Независимо от точной природы атома потеря альфа-и бета-частиц обязательно меняет его. Такой радиоактивный распад оказался источником еще большего числа членов периодической таблицы. Полоний и радий — продукты распада урана — были найдены в 1898 г. Пьером и Мари Кюри. Актиний, самый лёгкий из актиноидов, - в 1899. Радон был признан в 1900 г. Протактиний - в 1913 г.
Модели строения атома также стали более изощренными. В 1913 году Резерфорд и его датский коллега Нильс Бор предложили модель атома с электронами вокруг ядра, подобно планетам вокруг солнца, где электрическое притяжение играет роль гравитации. В том же году Генри Мосли, другой коллега Резерфорда, обнаружил математическую связь между рентгеновским спектром химического элемента при его бомбардировке электронами и его атомным номером в таблице. В «проблемных» парах вроде кобальта и никеля, где периодическая таблица якобы «шельмовала», Мосли доказал, что «шулерство» является корректным. Он организовал лантаноиды, предугадывая недостающие элементы, как до это делал Менделеев с другими элементами. Он также предсказал два новых переходных металла с атомными номерами 72 и 75, которые должным образом появились в 1923 (гафний) и 1925 (рений) годах.
Рентгеновские спектры Мосли показали, что атомный номер элемента не зависит непосредственно от его атомного веса. Резерфорд вскоре показал, что атомный номер на самом деле является числом положительно заряженных частиц в ядре, которое назвали протоном. Хотя протоны весят почти в 2 000 раз больше, чем электроны, они имеют равные (хотя и противоположные) заряды. В результате этого атом является электрически нейтральным. Однако протоны не являются достаточно тяжелыми для измерения атомных весов. Для их определения нужна ещё одна электрически нейтральная частица - нейтрон, который обнаружили в 1932 году. Нейтроны являются причиной того, что элемент может иметь атомы различных атомных весов, известные теперь как изотопы. Изотопы имеют разное количество нейтронов.
Впрочем, у модели атома Бора-Резерфорда был недостаток. Электростатические силы должны тянуть электроны к ядру, а не удерживать их на орбите. Но здесь на помощь пришла новая наука - квантовая механика. Квантовая теория говорит, что объекты атома являются как частицами, так и волнами. Волнообразный характер электронов означает, что когда они окружают атомное ядро, они создают самоподдерживающиеся трехмерные постоянные волны, называемые орбитальными. Стабильность этих постоянных волн удерживает электроны от падения на ядро. И это объяснение дало, наконец, базис для окончательного признания верности периодической таблицы.
Квантовая механика или spdf…
По причинам, которые скрываются глубоко в недрах квантовой механики, каждая орбитальная волна содержит один или два электрона и никогда больше. Сами орбитальные волны бывают разных типов и они формируют слои орбит (Shell) вокруг ядра. Первый слой содержит только волну типа “s”, состоящую максимум из двух электронов. Второй слой имеет волну “s” и три волны “p” и содержит до восьми электронов. Третий состоит из волны “s” трёх волн “p” и пяти “d”, где существует до 18 электронов. Четвёртый слой: 1 “s”, 3 “p”, 5 “d” и 7 “f”. В нём есть до 32 электронов. Ну и так далее. Аббревиатура spdf… берёт начало от спектральных линий, которые наблюдал Бунзен. Цвета этих линий визуально демонстрируют энергию, высвобождаемую электронами, которые меняют орбиты.
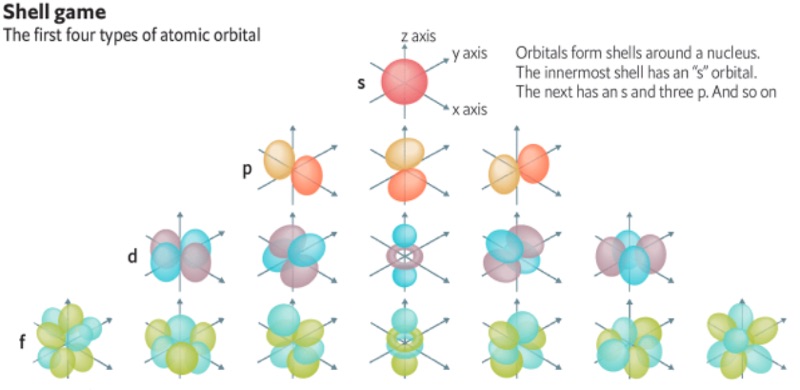
Собственно слои из орбитальных волн и являются тем, что мы знаем под периодической системой элементов. Каждый слой соответствует строчке в периодической таблице Менделеева. В первой строчке, которая содержит водород (один электрон) и гелий (два электрона) отображен первый слой. Вторая строчка от лития до неона заполнена химическими элементами с двумя слоями. И так далее.
Химические соединения создаются либо непарными электронами из разных атомов, образующих совместные орбиты, называемыми ковалентными связями, либо полной передачей непарных электронов между атомами, для создания парных орбитальных волн в реципиентах. Когда это происходит, полученные положительные и отрицательные ионы удерживаются вместе электростатическими силами — процессом, называемым ионным склеиванием.
Повторяющийся порядок, в котором оболочки заполнены в каждой строке таблицы, означает, что элементы в каждом столбце таблицы имеют одинаковую комбинацию непарных электронов, и, таким образом, аналогичные свойства. Например, благородные газы инертны, потому что у них нет непарных электронов. Более того, что разница между металлами и неметаллами зависит всего лишь от того, насколько легко внешние электроны атома могут теряться, Если они легко отсоединяются, то они:
- могут течь как электрический ток, что делает металлы проводимыми;
- отражать свет, что делает металлы блестящими;
- иметь пластичность, сохраняя твердую форму элемента.
И это, по сути, является окончательной разгадкой химии, но это ещё не конец истории.
Конец истории
В 1930-е гг. физики обнаружили, что радиоактивность может, по сути, быть отменена путем бомбардировки атомов податомными частицами для увеличения их атомных чисел. Это позволяет получать новые элементы. Технеций, созданный в 1937, был первым из них. Через 2 года появился франций, последний из элементов, который есть в естественной природе. Его получили как продукт распада актиния. С этого момента продление периодической таблицы стало работой для физиков, а не для химиков.
Технеций - очень странный элемент. Несмотря на свой низкий атомный номер (43) он не имеет стабильных изотопов, и таким образом найден в природе случайно. Это является своеобразием его физики протонов и нейтронов, которую он разделяет с прометием (61).
Но в конце таблицы, за свинцом (82), где собраны тяжёлые элементы, радиоактивность является обязательным для всех. И за пределами урана (92) она настолько обязательна, что когда-то думали о невозможности существования "трансурановых элементов" в природе.
Эта часть периодической таблицы стала игровой площадкой для Глена Теодора Сиборга, американского физика. В 1940-е гг. Сиборг был частью группы в Калифорнийском университете в Беркли, которая сделала нептуний (93). Когда руководитель группы ушла из университета, он стал новым главой. На его глазах были созданы америций (95), курион (96), (97), калифорний (98), эйнштейний (99), фермий (100), менделевий (101) и нобелий (102). Но его первое открытие - плутоний (94) в 1941 г. - стало самым важным. 16 июля 1945 года первая атомная бомба на основе плутония была испытана в Аламогордо, штате Нью-Мексико. 9 августа того же года бомба уничтожила город Нагасаки в Японии.
Америций также имеет практическое значение. Так как это был синтетический продукт, то он был запатентован Сиборгом. Его используют в детекторах дыма, и он дал приличный доход создателю. Но после 1995 года практическое значение расширения таблицы Менделеева стало все менее и менее очевидным, так как новые элементы стали все менее и менее стабильными.
Усилия по созданию новых элементов затухали после 1955 г., чтобы потом ненадолго возродиться в середине 1990-х годов. Ни химики, ни более широкий научный мир, однако, не не рукоплескали создателям дармштадтиума (110), рентгения (111), коперникума (112) или нихония (113), как это происходило при открытии калия, гелия, радия или плутония. То, что начиналось как «коллекционирование марок», вернулось к своим истокам, за исключением одной детали. Благодаря гению Менделеева охотники за элементами теперь имеют классификацию, чтобы помещать свои открытия в определенном порядке.
Самый тяжелый существующий элемент, оганесон (118), был создан в 2002 г., хотя получил название только в 2016 г. Оганесон завершает седьмой ряд таблицы. Химически он должен быть благородным газом. Но эксперименты велись всего с несколькими атомами элемента, а их жизнь измеряется в таких миллисекундах, что на практике узнать его свойства ещё долго будет сложно.
Несмотря на все усилия физиков, восьмой ряд не был начат. Но, как сказал сам Менделеев: "Понять, осознать и принять всю симметрию научного здания, в том числе его незаконченных частей, это эквивалентно получению наслаждения, которое дают только высшие формы красоты и истины". Для тех, кто разделяет это мнение и видит в периодической таблице высший пример поэзии природы, завершение последнего ряда с дообавлением оганесона может стать хорошим поводом для окончание сбора «коллекции марок», временем, когда пора остановиться.






